CAPA steht für Corrective Actions & Preventive Actions und ist Ihnen spätestens dann ein Begriff, wenn Sie sich mit der Guten Herstellungspraxis (Good Manufacturing Practice / GMP) oder der ISO 13485 auseinandergesetzt haben. Der CAPA-Prozess dient der systematischen Fehleranalyse und der Umsetzung von Korrektur- (Corrective Action) und Vorbeugemaßnahmen (Preventive Actions). Wie Ihnen das gelingt, erfahren Sie in diesem Artikel.
Anforderungen zu CAPA in der ISO 13485
In der Qualitätsmanagementnorm für Medizinprodukte, der ISO 13485, werden die Anforderungen an Korrektur- und Vorbeugungsmaßnahmen in aufeinanderfolgenden Kapiteln (8.5.2 Korrekturmaßnahmen und 8.5.3 Vorbeugungsmaßnahmen) aufgeführt. Die Norm ist im Gegensatz zur ISO 9001:2015 nicht nur darauf ausgelegt, die Organisation kontinuierlich zu verbessern, sondern stellt vornehmlich die Sicherheit von Medizinprodukten in den Vordergrund. Vor diesem Hintergrund ist die Durchführung eines CAPA-Prozesses von großer Bedeutung.
Die in Kapitel 8.5.2 Korrekturmaßnahmen (Corrective Actions) geforderten Korrekturmaßnahmen ähneln weitestgehend denen der ISO 9001. Im Grunde muss die Organisation das erneute Auftreten eines Fehlers verhindern, indem Sie folgende Anforderungen erfüllt:
Sie müssen die Nichtkonformitäten (Fehler) bewerten, deren Ursache ermitteln und den Handlungsbedarf zur Vermeidung des erneuten Auftretens beurteilen.
Im Kapitel 8.5.3 sind die Anforderungen für Vorbeugungsmaßnahmen (Preventive Actions) festgelegt. Hierbei handelt es sich um eine Risikobewertung. Es geht darum mögliche Quellen für vergleichbare Fehler zu identifizieren und die notwendigen Präventionsmaßnahmen zu ergreifen. Hierbei gilt zu beachten, dass die Vorbeugungsmaßnahmen immer in einem angemessenen Verhältnis zu dem Risiko stehen müssen.
Jeder CAPA-Prozess muss vollständig dokumentiert werden. Dies beinhaltet sowohl die festgestellten Fehler als auch die Planung und Umsetzung der Korrektur- und Vorbeugemaßnahmen. Darüber hinaus muss geprüft werden, ob die Maßnahmen wirksam sind und inwieweit diese das Produkt nachteilig beeinflussen. Diese Prüfungen müssen ebenfalls dokumentiert werden.
Diese Prüfungen sind notwendig um festzustellen, ob der Fehler tatsächlich korrigiert wurde, dies geschieht z.B. durch den Qualitätsmanager. Die Durchführung der CAPA sollte im Idealfall von einem Team durchgeführt werden, um über die optimalen Ressourcen zu verfügen, die die Untersuchung und Korrektur des Fehlers ermöglichen.
So bilden Sie CAPA in qmBase ab
qmBase unterstützt Sie in der Umsetzung und Dokumentation Ihres CAPA-Prozesses. qmBase ist eine Universallösung, sie kann von Unternehmen aus den unterschiedlichsten Branchen genutzt werden. qmBase verzichtet bewusst auf eine extra App für die Umsetzung und Dokumentation des CAPA-Prozesses. Vielmehr fügen sich CAPA perfekt in die bestehende Funktionalität ein.
Wussten Sie schon? Der CAPA Prozess wird nicht nur von der ISO 13485 gefordert, sondern ist auch Bestandteil der Good Manufacturing Practice (GMP) und wird zudem von der Food and Drug Administration (FDA) gefordert. Die US-amerikanische Behörde schützt die öffentliche Gesundheit in den USA. Sie kontrolliert die Sicherheit und Wirksamkeit unter anderem von Arzneimitteln der Human- und Tiermedizin, von Medizinprodukten, Lebensmitteln und Kosmetik. Für deutsche Unternehmen hat dies keine Auswirkung, sofern sie nicht in die USA exportieren wollen. Dann gelten auch für deutsche Unternehmen die strengen Richtlinien der FDA, wie zum Beispiel dem Transport von Lebensmittelerzeugnissen in einem von der FDA zugelassenen Kunststoff.
Korrekturmaßnahmen mit qmBase umsetzen
Sie beginnen mit der Erfassung von Nichtkonformitäten. Hierzu berufen Sie sich auf interne Fehlermeldungen, Kunden- oder Lieferantenreklamationen, Auditabweichungen oder Abweichungen der Kennzahlen. Um die Fehlerursache zu ermitteln, können Sie z.B. ein Ishikawa Diagramm nutzen.
Für eine effiziente und standardisierte Bearbeitung erfassen Sie die Abweichung als Reklamation im Reklamationsmanagement Sie können die Informationserfassung im Reklamationsmanagement an Ihre Anforderungen anpassen. Zu jeder Reklamation definieren Sie die verantwortlichen Personen und Bearbeitungsfristen.
Die Sofort-, Korrektur- und Vorbeugemaßnehmen werden im Maßnahmenmanagement erstellt und direkt mit der Reklamation verknüpft.
Wussten Sie schon? Der Unterschied zwischen einer Sofortmaßnahme und einer Korrekturmaßnahme ist, dass die Sofortmaßnahme zur Schadensbegrenzung eingesetzt werden z.B. der Rückruf eines fehlerhaften Produkts. Bei der Korrekturmaßnahme handelt es sich um eine Maßnahme, die das Problem des Produkts beheben soll. Eine Vorbeugungsmaßnahme, die insbesondere im 2. Teil des CAPA-Prozesses relevant ist, ist eine Maßnahme, die durchgeführt wird, bevor der Schaden entstanden ist. Zum Beispiel die Schulung von Mitarbeitern oder der Austausch von Maschinen.
Jede Maßnahmen verfügt dabei über individuelle Fristen und Verantwortlichkeiten. Auch Fehlerursachen lassen sich direkt jeder Reklamation zuordnen.
Durch diese Zuordnungen werden die Zusammenhänge sichtbar, die für eine effiziente und motivierte Bearbeitung notwendig sind. Mithilfe von Schlagworten können Sie die Reklamationen und Maßnahmen, die Sie CAPA-konform erstellt haben, deutlich zuordnen und für alle Parteien, sowohl für Mitarbeiter des Unternehmens als auch für Auditoren transparent kennzeichnen.
Durch die Nutzung von qmBase erledigen Sie die entsprechende Dokumentation nebenbei. Darüber hinaus ist auch die Auswertung der Wirksamkeit, in Form eines 8-D Reports direkt über die Software zu erstellen. Somit erfüllen Sie durch die Nutzung des Reklamationsmanagements von qmBase die Anforderungen des Kapitels 8.5.2
Mehr Informationen zum Reklamationsmanagement finden Sie hier.
Vorbeugungsmaßnahmen mit qmBase umsetzen
Kommen wir nun zu den Anforderungen des Kapitels 8.5.3. Um die Präventionsmaßnahmen einleiten zu können, müssen die diese erst im Risikomanagement erfassen. Sie sollten beachten, dass Sie an dieser Stelle potenzielle Risiken erfassen. Das Ziel ist es, auf Grundlage von Prozessanalysen, einen Verbesserungsbedarf zu ermitteln und diesen umzusetzen um Fehler frühzeitig zu vermeiden. Zur Risikoermittlung können Sie diverse Methoden benutzen, zum Beispiel die SWOT-Analyse. Die qmBase App Risiken & Chancen ermöglicht Ihnen, genau wie das Reklamationsmanagement, die schnelle Erfassung und die Zuordnung von klaren Verantwortlichkeiten.
Um Ihre Risiken für Sie sinnvoll zu bewerten, erstellen Sie Ihre eigenen Risikokategorien, angepasst an Ihre individuellen Bewertungskriterien. Damit die Risiken regelmäßig überwacht werden, definieren Sie ein individuelles Bewertungsintervall für jede Kategorie.
Anschließend verknüpfen Sie das erfasste Risiko direkt mit einer entsprechenden Maßnahme, für die Sie ebenfalls klare Verantwortlichkeiten und Fristen definieren. Auch hier verwenden Sie Schlagworte für die bessere Auffindbarkeit Ihrer Vorbeugungsmaßnahmen.
Hier finden Sie mehr Informationen zur App Risiken & Chancen.
Zur Veranschaulichung haben wir Ihnen die wichtigsten Punkte noch einmal in einem Schaubild zusammengefasst.
Schaubild CAPA Prozess
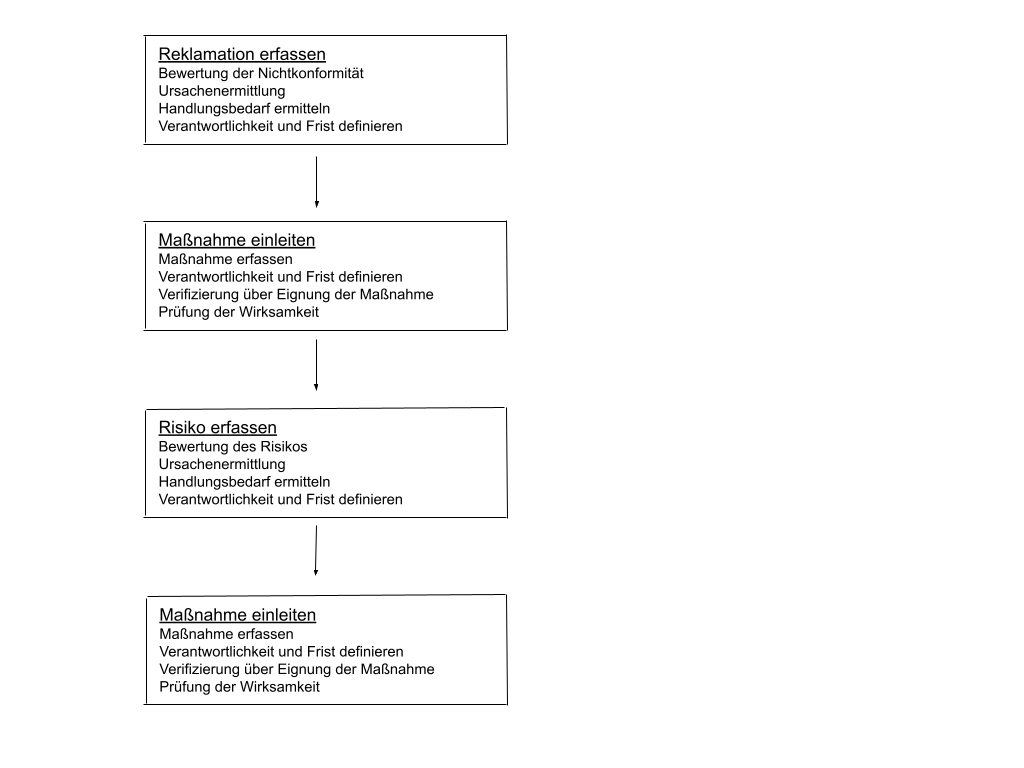
Hier finden Sie die wichtigsten Schritte des CAPA Prozesses zusammengefasst
Jetzt sind Sie dran! Sichern Sie sich noch heute Ihre kostenlose Demo für die qmBase Software und überzeugen Sie sich davon, wie unkompliziert Sie mit qmBase den CAPA-Prozess abbilden können. Darüber hinaus bietet qmBase weitere Apps, die Ihnen den Arbeitsalltag leichter machen. Vom Auditmanagement bis zum Zielmanagement bieten wir Ihnen die Unterstützung, die Sie für Ihr Audit und Ihre Unternehmensorganisation brauchen.
Wir machen Software, damit Sie besser organisiert sind.
Share this Post


